


Übung macht den Meister. So gehört auch eine gewisse Übung zu der Fähigkeit, aus vielen Informationen die Essenz zu gewinnen, sie auf den Punkt zu bringen und dann möglichst effizient in die Praxis der Klausuren umzusetzen.
Aus zahlreichen Fragenstellungen, die sich während der Betreuung von Seminar- und Praktikumsveranstaltungen ergaben, entstand die Idee dieses Buches.
Seinem Konzept entsprechend soll eine einfache Zusammenstellung der Grundlagen und der wichtigsten Gesetzmäßigkeiten der Chemie dem Leser als Hilfe bei der Einordnung des Lernstoffes dienen.
Dieses Buch enthält eine große Anzahl repräsentativer Aufgaben, die sich an den Themen des Kurses "Chemie für Mediziner und Zahnmediziner" orientieren.
Jedes Kapitel enthält eine kurze Darstellung aller Prinzipien, die zum Verständnis und zur Lösung der Aufgaben notwendig sind.
Sie haben daher verschiedene Möglichkeiten, das Skript zu nutzen.
Auch das Layout schafft eine zusätzliche Strukturierung, hilft dem Leser auf einen Blick die Textteile (vor allem die Formeln) zu erkennen, die für ihn relevant sind, und lässt genügend Raum für Notizen.
Also, wer nicht wagt, der nicht gewinnt!
Victor Chameko
1. Der Atombau - eine Modellvorstellung
1.1 Der Atomkern
1.2 Die Elektronenhülle
1.3 Quantenzahlen
1.4 Pauli-Prinzip
1.5 Hundsche Regel
1.6 Elektronenkonfiguration
1.7 Elektronegativität
1.8 Übungsaufgaben
2. Chemische Bindung
2.1 Ionenbindung
2.2 Atombindung (kovalente Bindung)
2.2.1 Polarisierte Atombindung
2.2.2 Dipolmoleküle
2.3 Metallbindung
2.4 Koordinative Bindung
2.4.1 Nomenklatur der Metallkomplexverbindungen
2.5 Zwischenmolekulare Kräfte
2.5.1 Wasserstoffbrückenbindung
2.5.2 Van der Waals Kräfte
2.6 Übungsaufgaben
3. Stoffmengen
3.1 Übungsaufgaben
4. Konzentrationsangaben von Lösungen
4.1 Massenprozent
4.2 Volumenprozent
4.3 Molenbruch
4.4 Molarität (molare Konzentration)
4.5 Molalität
4.6 Normalität
4.7 Dichte
4.8 Übungsaufgaben
5. Reaktionsgleichungen
5.1 Säure-Base-Reaktionen
5.2 Fällungs-Reaktionen (Doppelte Umsetzungen)
5.3 Komplexbildung
5.4 Redox-Reaktionen
5.5 Chemische Formeln und Gleichungen
5.6 Stöchiometrische Berechnungen
5.7 Übungsaufgaben
6. Chemische Thermodynamik
6.1 Enthalpie
6.2 Entropie
6.3 Die Triebkraft chemischer Reaktionen
6.4 Übungsaufgaben
7. Chemisches Gleichgewicht
7.1 Massenwirkungsgesetz
7.2 Das Prinzip von Le Chatelier
7.2.1 Einfluss der Temperatur
7.2.2 Einfluss des Drucks
7.2.3 Einfluss der Konzentration
7.3 Freie Reaktionsenthalpie
7.4 Löslichkeitsprodukt
7.5 Übungsaufgaben
8. Säuren und Basen
8.1 pH-Wert
8.2 pOH-Wert
8.3 pKs, pKb
8.4 Berechnung von pH-Werten
8.4.1 Starke Säuren und Basen
8.4.2 Schwache Säuren und Basen
8.5 Neutralisation
8.6 Titration
8.6.1 Titration einer starken Säure mit einer starken Base
8.6.2 Titration einer schwachen Säure mit einer starken Base
8.6.3 Titration einer schwachen Base mit einer starken Säure
8.7 Puffersysteme
8.8 Übungsaufgaben
9. Redox- und Elektrochemie
9.1 Oxidation und Reduktion
9.2 Oxidationszahlen in Molekülen
9.3 Oxidationszahlen in Ionen
9.4 Ermittlung der Oxidationszahlen
9.5 Regeln zum Erstellen von Redoxgleichungen
9.6 Elektrochemie
9.6.1 Galvanische Zellen
9.6.2 Normalwasserstoffelektrode
9.7 Nernstsche Gleichung
9.7.1 Konzentrationszellen
9.8 Übungsaufgaben
10. Spezielle analytische Verfahren
10.1 Photometrische Bestimmungen
10.2 Dünnschicht-Chromatographie (DC)
10.3 Ionenaustauscher
10.4 Extraktion
10.5 Übungsaufgaben
11. Nomenklatur der Organischen Chemie
11.1 Übungsaufgaben
12. Isomerie
12.1 Konstitutionsisomerie
12.1.1 Kettenisomerie
12.1.2 Stellungsisomerie
12.1.3 Isomerie funktioneller Gruppen
12.1.4 Keto-Enol-Tautomerie
12.2 Konfigurationsisomerie
12.2.1 Enantiomerie (Optische Isomerie)
12.2.2 Diastereomerie
12.2.3 π-Diastereomerie (cis-trans-Isomerie)
12.2.4 σ-Diastereomerie
12.3 Konformationsisomerie
12.4 Übungsaufgaben
13. Induktivität und Mesomerie
13.1 Der Induktive Effekt
13.2 Der Mesomere Effekt
13.3 Übungsaufgaben
14. Organische Reaktionen
14.1 Zur Klassifizierung organischer Reaktionen
14.2 Substitution (Austauschreaktion)
14.2.1 Radikalische Substitution (SR)
14.2.2 Monomolekulare nukleophile Substitution (SN1)
14.2.3 Bimolekulare nukleophile Substitution (SN2)
14.2.4 Elektrophile Substitution (SE)
14.2.5 Zweitsubstitution
14.3 Addition (Anlagerungsreaktion)
14.3.1 Elektrophile Addition (AE)
14.4 Eliminierung (Abspaltungsreaktion)
14.4.1 Monomulekulare Eliminierung (E1)
14.4.2 Bimolekulare Eliminierung (E2)
14.5 Redoxreaktionen
14.5.1 Oxidationszahlen
14.5.2 Oxidation von Alkoholen
14.5.3 Oxidation von Thioalkoholen
14.5.4 Oxidation von Aldehyden
14.5.5 Silberspiegelprobe
14.5.6 Fehlingreaktion
14.6 Übungsaufgaben
15. Verbindungsklassen
15.1 Übersicht einiger Funktionalitäten
15.2 Übungsaufgaben
16. Kohlenwasserstoffe
16.1 Alkane CnH2n+2
16.1.1 Wichtige Reaktionen der Alkane
16.2 Alkene CnH2n
16.2.1 Wichtige Reaktionen der Alkene
16.3 Alkine CnH2n-2
16.3.1 Wichtige Reaktionen der Alkine
16.4 Benzol und seine Derivate
16.4.1 Aromatische Radikale
16.4.2 Wichtige Reaktionen der Aromaten
17. Verbindungen mit funktionellen Gruppen
17.1 Alkohole R-OH
17.1.1 Wichtige Reaktionen der Alkohole
17.2 Phenole
17.2.1 Wichtige Reaktionen der Phenole
17.3 Ether R1-O-R2
17.4 Amine
17.5 Übungsaufgaben
18. Carbonylverbindungen
18.1 Aldehyde R-CHO
18.1.1 Wichtige Reaktionen der Aldehyde
18.2 Ketone
18.2.1 Wichtige Reaktionen der Ketone
18.3 Übungsaufgaben
19. Carbonsäuren und ihre Derivate
19.1 Monocarbonsäuren
19.1.1 Gesättigte Monocarbonsäuren
19.1.2 Ungesättigte Monocarbonsäuren
19.1.3 Aromatische und heterocyclische Monocarbonsäuren
19.2 Dicarbonsäuren
19.2.1 Gesättigte Dicarbonsäuren
19.2.2 Ungesättigte Dicarbonsäuren
19.2.3 Aromatische Dicarbonsäuren
19.3 Substituierte Carbonsäuren
19.3.1 Halogencarbonsäuren
19.3.2 Hydroxycarbonsäuren
19.3.3 Ketocarbonsäuren
19.3.4 Wichtige Reaktionen der Carbonsäuren
19.3.5 Medizinisch wichtige Substanzen
19.4 Carbonsäurederivate
19.4.1 Wichtige Reaktionen der Carbonsäurederivate
19.5 Carbonsäurehalogenide
19.5.1 Darstellung
19.6 Anhydride
19.7 Ester
19.7.1 Cyclische Ester (Lactone)
19.7.2 Thioester
19.7.3 Ester anorganischer Säuren
19.8 Amide
19.8.1 Cyclische Amide (Lactame)
19.9 Übungsaufgaben
20. Naturstoffe
20.1 Zucker
20.1.1 Einteilung nach Zahl der Kohlenhydrat-Reste
20.1.2 Einteilung nach funktionellen Gruppen
20.1.3 Einteilung nach der Anzahl der Sauerstoffatome
20.1.4 Optische Aktivität
20.2 Pentosen
20.3 Hexosen
20.3.1 D-Glucose
20.3.2 D-Mannose
20.3.3 D-Galactose
20.3.4 D-Fructose
20.4 Ringformeln (Haworth-Formeln)
20.5 Disaccharide
20.5.1 Saccharose
20.5.2 Lactose
20.5.3 Maltose
20.6 Polysaccharide
20.6.1 Stärke
20.6.2 Glycogen
20.6.3 Cellulose
20.7 Aminosäuren (AS)
20.7.1 AS mit unpolaren Substituenten
20.7.2 AS mit polaren Substituenten
20.7.3 AS mit von Carbonsäuren abgeleiteten Subtituenten
20.7.4 AS mit basischen Substituenten
20.7.5 Peptidbindung
20.8 Fette
20.9 Übungsaufgaben
21. Lösungen der Aufgaben
21.1 Zum Kapitel 1
21.2 Zum Kapitel 2
21.3 Zum Kapitel 3
21.4 Zum Kapitel 4
21.5 Zum Kapitel 5
21.6 Zum Kapitel 6
21.7 Zum Kapitel 7
21.8 Zum Kapitel 8
21.9 Zum Kapitel 9
21.10 Zum Kapitel 10
21.11 Zum Kapitel 11
21.12 Zum Kapitel 12
21.13 Zum Kapitel 13
21.14 Zum Kapitel 14
21.15 Zum Kapitel 15
21.16 Zum Kapitel 17
21.17 Zum Kapitel 18
21.18 Zum Kapitel 19
21.19 Zum Kapitel 20

Die Atome sind die kleinsten Masseteilchen der Elemente, die noch die Eigenschaften des jeweiligen Elements aufweisen. Sie sind auf chemischem Weg nicht teilbar.
Nach E. Rutherford (1911) besteht jedes Atom aus Atomkern und Elektronenhülle. Die Elektronenhülle besteht aus Elektronen, die den Atomkern umkreisen.
Elektronen tragen eine negative Elementarladung und haben eine äußerst geringe Masse (1/1836 der Masse des Wasserstoffkerns). Die Masse eines Atoms ist fast vollständig im Kern konzentriert.
Zwischen dem Atomkern und den Elektronen bestehen sehr große Abstände. Der Durchmesser eines Atoms, d.h. der Durchmesser der Elektronenhülle eines Atoms liegt in der Größenordnung von 10-10 m. Der Durchmesser eines Atomkerns liegt dagegen in der Größenordnung von 10-15 m, er beträgt also nur etwa 1/100000 Atomdurchmessers.
Die Atomkerne bestehen aus zwei Arten von Nukleonen (Kernbausteine), die nahezu massegleich sind: den Protonen und den Neutronen.
Das Proton trägt eine positive Elementarladung. Das Neutron ist ungeladen. Die Atome eines Elements besitzen die gleiche Protonenzahl, die als Ordnungszahl Z (Kernladungszahl) bezeichnet wird und für jedes Element charakteristisch ist.
In jedem ungeladenen Atom ist die Anzahl der positiv geladenen Protonen gleich der Anzahl der negativ geladenen Elektronen.
Während die Anzahl der Protonen bei allen Atomen eines Elements gleich ist, kann die Anzahl der Neutronen unterschiedlich sein. Die Gesamtzahl der Nukleonen (Protonen+Neutronen) wird Massenzahl A genannt. Die Zahl der Neutronen ergibt sich somit zu (A-Z).
Der allgemeinere Begriff Nuklid kennzeichnet jede Atomkernart mit gegebener Massenzahl A und Ordnungszahl Z. Die Nuklide werden in der Schreibweise dadurch gekennzeichnet, dass die Massenzahl dem Elementsymbol als Superscript vorangestellt wird und die Ordnungszahl als Subscript angeführt wird (z.B. ![]() C).
C).
Nuklide, die die gleiche Ordnungszahl besitzen und daher zum gleichen Element gehören, bezeichnet man als Isotope. Alle Isotope haben die gleichen chemischen Eigenschaften.
Nach der Modelvorstellung von N. Bohr (1913) umkreisen Elektronen als Träger der negativen Ladung den Atomkern. Demnach bewegt sich jedes Elektron auf einer eigenen Bahn um den Kern. Gruppen von Elektronen mit ähnlichem Energiezustand bezeichnet man als Elektronenschalen. Die Elektronenschalen werden von innen nach außen nummeriert oder mit den Buchstaben K, L, M, N, O, P und Q bezeichnet. Die maximale Besetzung einer Elektronenschale beträgt 2n2, wobei n die Nummer der Elektronenschale (Hauptquantenzahl) ist. Demnach beträgt
Die Elektronen der äußersten Schale eines Atoms werden Valenzelektronen genannt. Sie werden vom Kern am wenigsten fest gebunden und können daher relativ leicht abgespalten werden. Nur die Valenzelektronen werden bei einer chemischen Reaktion benötigt.
Die Belegung der jeweils äußersten Schale mit 8 Elektronen (erste Schale nur zwei) ist ein energetisch stabiler Zustand. Man nennt ihn Edelgaskonfiguration, da alle Edelgase (außer Helium) diese Zahl von Valenzelektronen aufweisen. Alle Atome sind bestrebt, diesen stabilen Zustand zu erreichen, was z.B. durch Aufnahme zusätzlicher Valenzelektronen von anderen Atomen oder durch Abgabe eigener Valenzelektronen erreicht werden kann.
Da Elektronen gleichzeitig Teilchen- und Welleneigenschaften haben, reicht das Bohrsche Atommodel nicht aus, um den Wellencharakter der Elektronen zu beschreiben. Dies ist mit Hilfe der Schrödinger-Gleichung möglich. Sie vereinigt die von Bohr geforderte Quantenbeschränkung der Energie des Elektrons mit seiner Beschreibung als Welle. Mit Hilfe der Schrödinger-Gleichung lässt sich eine Funktion ableiten, die das Elektron als Energiewelle oder als eine Wolke negativer Ladung mit unterschiedlicher Ladungsverteilung beschreibt. Die Lösungsfunktionen dieser Gleichung (Wellenfunktionen) geben die Wahrscheinlichkeit an, mit der ein Elektron in einer bestimmten Entfernung vom Kern anzutreten ist.
Dieser Aufenthaltswahrscheinlichkeitsraum der Elektronen wird als Orbital bezeichnet.
Die Orbitale müssen mathematisch bestimmte Bedingungen erfüllen, um physikalisch sinnvoll zu sein.
Die Gliederung der Elektronen in Orbitale erfolgt durch die Quantenzahlen.
Jedes Elektron kann demnach durch die vier Quantenzahlen beschrieben werden.
Die Elektronen in einem Atom müssen sich in mindestens einer der vier Quantenzahlen unterscheiden.
Beim Auffüllen der Atomhülle werden die Orbitale mit den gleichen Quantenzahlen n, l und m zunächst mit je einem Elektron besetzt; erst wenn alle Orbitale einfach besetzt sind, werden die Orbitale mit Elektronen von entgegengesetztem Spin aufgefüllt. Das entspricht dem niedrigsten Energiezustand des Atoms. Beim Auffüllen der d- und f-Orbitale mit Elektronen nehmen halbbesetzte Orbitale eine Sonderstellung ein als energetisch besonders stabil. Entsprechendes gilt für die Vollbesetzung.
Die Besetzung der Orbitale kann durch Elektronenkonfiguration wiedergegeben werden. Beim Auffüllen der Orbitale soll man mit dem energieärmsten 1s-Orbital beginnen sowie das Pauli-Prinzip und Hundsche Regel beachten.
In der Schreibweise wird als erstes die Hauptquantenzahl, dann die Nebenquantenzahl und dann die Anzahl der Elektronen, die sich in dem jeweiligen Orbital befinden, als Exponent dargestellt.
Beispiele
6C: 1s2 2s2 2p2
11Na: 1s2 2s2 2p6 3s1
15P: 1s2 2s2 2p6 3s2 3p3
20Ca: 1s2 2s2 2p6 3s2 3p6 4s2
35Br: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
Um die Reihenfolge der Niveaubesetzung behalten zu können, werden zahlreiche Gedächtnisstützen vorgeschlagen. Eine dieser Methoden ist in der Abbildung dargestellt.
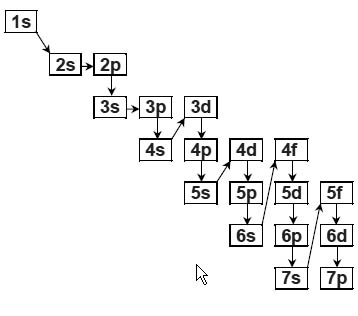
Die Elektronegativität (EN) kennzeichnet das Bestreben der Atome eines Elements, Elektronen anzuziehen. Elemente mit geringer Elektronegativität geben relativ leicht Elektronen ab. Elemente mit hoher Elektronegativität bauen leicht Elektronen in ihre äußere Schale ein. Willkürlich wird die Elektronegativität des elektronegativsten Element Fluor gleich 4 gesetzt. Die Elektronegativität nimmt innerhalb einer Gruppe ab und innerhalb einer Periode (von links nach recht) zu.
| H = 2,2 | ||||||
| Li = 1,0 | Be = 1,6 | B = 2,0 | C = 2,6 | N = 3,0 | O = 3,4 | F = 4,0 |
| Na = 0,9 | Mg = 1,3 | Al = 1,6 | Si = 1,9 | P = 2,2 | S = 2,6 | Cl = 3,2 |
| K = 0,8 | Br =3,0 | |||||
| I = 2,7 |


Die Ionenbindung ist die elektrostatische Anziehung zwischen entgegengesetzt geladenen Ionen. Sie ist ungerichtet. Gitterenergie beträgt ca. 700 - 2000 kJ/mol und hängt von der Ladungsdichte der Ionen ab.
Positive Ionen werden als Kationen, negative als Anionen bezeichnet. So wird z.B. bei der Reaktion eines Natriumatoms mit einem Chloratom ein Elektron von Natrium auf Chlor übertragen:
Na + Cl → Na+ + Cl-
Die Elektronenkonfiguration des Natriums ist 1s22s22p63s1 und die des Chlors 1s22s22p63s23p5. Nach der Reaktion erreichen beide die Edelgaskonfiguration (Na+: 1s22s22p6; Cl-: 1s22s22p63s23p6).
Wenn Sauerstoff eine ionische Reaktion eingeht, nimmt jedes Sauerstoffatom (1s22s22p4) zwei Elektronen auf und erreicht damit Neon-Konfiguration (1s22s22p6) Das Oxidion trägt die Ladung -2.
Bei Reaktion von Natrium mit Sauerstoff werden für jedes einzelne Sauerstoffatom zwei Natriumatome benötigt, weil die Anzahl der aufgenommenen Elektronen gleich der Anzahl der abgegebenen Elektronen sein muss:
2Na + O → 2Na+ + O2-
Die Formel des Reaktionsprodukts (Natriumoxid) ist Na2O. In der Formel zeigt der Index 2 für Natrium und der (nicht geschriebene) Index 1 für Sauerstoff das einfachste Verhältnis der in jedem Kristall dieser Substanz vorhandene Ionen an.
Beispiel
Das Aluminiumatom besitzt 3 Valenzelektronen (1s22s22p63s23p1
2Al + 3O → 2Al3+ + 3O2- → Al2O3